CHAPITRE C7 : Solutions aqueuses acides
I. Catégorisation des solutions aqueuses
-Dispositif expérimental et manipulations
Nous disposons de 7 tubes à essais numérotés de 1 à 7. Introduisons dans chaque tube quelques gouttes de bleu de bromothymol (BBT).




- Ajoutons respectivement dans les 6 premiers tubes à essai quelques gouttes des solutions suivantes : Jus de citron, eau savonneuse, jus d’oseille blanc, solution de « khémé », eau salée, solution d’acide chlorhydrique.
Observations :
Le BBT prend alors les colorations suivantes :

Les résultats obtenus peuvent être résumés dans le tableau ci-dessous :
|
Numéro tubes à essai
|
Solutions
|
Couleur prise par le BBT
|
|
1
|
Jus de citron
|
jaune
|
|
2
|
Eau savonneuse
|
bleu
|
|
3
|
Jus d’oseille blanc
|
jaune
|
|
4
|
Solution de « khémé »
|
bleu
|
|
5
|
Eau salée
|
vert
|
|
6
|
Acide chlorhydrique
|
jaune
|
-Conclusions et définitions:
On peut donc classer les solutions aqueuses en 3 catégories :
- Celles comme le jus de citrons, le jus d’oseille blanc qui font virer le BBT au jaune. Elles sont dites acides
- Celles comme l’eau savonneuse qui font virer le BBT au bleu. Elles sont dites basiques
- Celles comme l’eau salée qui ne font pas virer le BBT sont dites neutres.
II. L’acide Chlorhydrique
II.1. Préparation de la solution d’acide chlorhydrique
II.1.1) Le chlorure d’hydrogène
- Structure :
Le chlorure d’hydrogène est un gaz moléculaire de formule HCl. La liaison covalente entre l’atome d’hydrogène et l’atome de chlore est polarisée (fragile) du fait de la différence d’électronégativité.
- Propriétés physiques :
Dans les conditions ordinaires de température et de pression, le chlorure d’hydrogène est un gaz incolore d’odeur piquante, très irritant pour les voies respiratoires. Il est plus dense que l’air
- Préparation du chlorure d’hydrogène
On peut obtenir le chlorure d’hydrogène(HCl) facilement par l’action de l’acide sulfurique (H2SO4) sur le chlorure de sodium (NaCl) avec un léger échauffement : H2SO4 + 2NaCl 2HCl + Na2SO4

Le gaz HCl est recueilli par déplacement d’air.
II.1.2) Dissolution du gaz chlorhydrique : expérience du jet d’eau
Un ballon à fond rond de 500 mL muni d’un bouchon à tube effilé à l’une de ses extrémités est rempli de gaz chlorhydrique
Un cristallisoir est rempli d’eau distillée dans lequel on a ajouté quelques gouttes de BBT (coloration verte).
- Manipulation et Observations:
On introduit dans le ballon rempli de gaz chlorhydrique une goutte d’eau à l’aide d’un tube effilé rempli de chlorure d’hydrogène, on bouche l’extrémité du tube avec le doigt et on agite pour dissoudre le gaz. Puis on retourne le ballon et on plonge l’extrémité du tube dans la cuve contenant la solution verte.
De l’eau pénètre vivement dans le ballon produisant un jet d’eau de couleur jaune.


Interprétation:
Les premières gouttes d’eau qui entrent dans le ballon ont dissout pratiquement tout le gaz créant ainsi un vide poussé. L’eau est ainsi aspirée dans le ballon sous forme d’un jet.
En dissolvant le chlorure d’hydrogène la solution obtenue est acide d’où la coloration jaune : c’est la solution d’acide chlorhydrique.
Application1
On prépare une solution d’acide chlorhydrique de volume V=500mL en dissolvant un volume V1=480mL de chlorure d’hydrogène dans de l’eau. Sachant que dans les conditions de l’expérience le volume molaire est égale Vm= 24 L.mol-1.
- Ecrire l’équation de dissociation du chlorure d’hydrogène.
- Calculer la concentration molaire et massique de la solution d’acide chlorhydrique ainsi obtenue.
Solution
- Equation de dissociation :
HCl+H2O→H3O++Cl-
- Calcul de la concentration molaire et massique
C=V1Vm×V→C=24024×500C=0,02mol.L-1
Cm=C×MHClCm=0,02×36,5→Cm=0,73g.L-1
II.2. Propriétés de la solution d’acide chlorhydrique
II.2. 1) Conductibilité électrique
- Expérience

Réalisons le circuit ci-contre. L’électrolyseur contient une solution d’acide chlorhydrique.
- observation
On observe que l’ampoule brille quand on forme l’interrupteur
- interprétation
La solution d’acide chlorhydrique conduit le courant électrique donc elle contient des ions. Lors de la dissolution l’eau a totalement ionisé les molécules d’acide chlorhydrique selon l’équation-bilan :
HCl+H2O→ H3O++Cl-
II.2. 2) Propriétés des ions Hydronium
- Action sur les métaux
Soient deux tubes à essai contenant respectivement une solution d’acide chlorhydrique et une solution de chlorure sodium. Mettons dans chaque tube de la grenaille de zinc.
Observation
On constate que le métal disparait dans le tube contenant la solution d’acide chlorhydrique avec un dégagement de H2, tandis qu’il reste intact dans le tube contenant la solution de chlorure de sodium
L’action de l’acide chlorhydrique sur le zinc est due à une réaction entre les ions H3O+ et le métal.
Les ions H3O+ attaquent les métaux qui leurs plus électropositifs comme le zinc, l’aluminium, le fer, le plomb, le nickel etc.… Ils n’attaquent pas le cuivre, l’argent ou l’or (qui sont moins électropositifs)
- Action sur les indicateurs colorés
Un indicateur coloré est une substance qui donne des colorations différentes suivant qu’il se trouve en milieu acide, basique ou neutre.
Soient trois tubes à essai A, B et C contenant respectivement quelques gouttes d’hélianthine, de phénolphtaléine et de BBT, introduisons dans chaque tube quelques gouttes d’une solution d’acide chlorhydrique.
- Observation : Les résultats obtenus sont résumés dans le tableau ci-dessous.
|
indicateur
|
hélianthine
|
phénolphtaléine
|
BBT
|
|
Couleur initiale de l’indicateur
|
Jaune
|
Incolore
|
vert
|
|
Couleur de l’indicateur en présence d’acide chlorhydrique
|
Rouge
|
Incolore
|
Jaune
|
II.2. 3) Propriétés des ions Cl-
Dans un tube à essai contenant de l’acide chlorhydrique, ajoutons quelques gouttes d’une solution de nitrate d’argent (AgNO3).
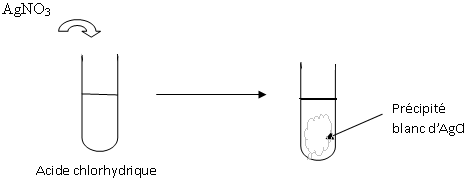
Il se forme un précipité blanc de chlorure d’argent qui noircit à la lumière.
Les ions argent Ag+ et les ions Cl- ne peuvent coexister en solution aqueuse. La réaction de précipitation se traduit par l’équation-bilan :
Ag+ + Cl- AgCl
III. Généralisation : Autres acides
III.1. Définition
Selon Bronsted, un acide est une espèce chimique pouvant libérer un ou plusieurs protons H+ en solution (H+ionisé par H2O pour donner H3O+)
On distingue les monoacides et les polyacides :
- Lorsqu’une mole peut libérer une mole d’ions H+, l’acide est un monoacide.
- Lorsqu’une mole d’acide peut libérer deux ou trois ions H+, l’acide est un diacide ou triacide.
III.2. Exemples.
|
monoacide
|
diacide
|
triacide
|
|
Acide chlorhydrique (HCl), acide nitrique (HNO3), acide éthanoïque (CH3COOH)
|
Acide sulfurique (H2SO4)
|
Acide phosphorique (H3PO4)
|
EVALUATION :
Exercice1 :
Répondre par vrai ou faux en cochant la case correspondante.
|
Affirmations
|
Vrai
|
Faux
|
|
Le jus de citron est acide
|
|
|
|
L’acide chlorhydrique attaque le métal argent
|
|
|
|
Le chlorure d’hydrogène est très soluble dans l’eau
|
|
|
|
Il est possible de garder de l’acide chlorhydrique dans un flacon en aluminium
|
|
|
Exercice2 :
Ecrire et équilibrer l’équation de la réaction de préparation du chlorure d’hydrogène à partir d’acide sulfurique et de chlorure de sodium. Nommer les produits formés
Exercice3 :
On fait agir 50mL d’une solution d’acide chlorhydrique, de concentration molaire 0,5mol.L-1, sur de la grenaille de zinc en excès.
- Quel volume de gaz peut-on espérer recueillir.
- Quelle masse maximale de solide devrait-on recueillir, après filtration et évaporation de la solution obtenue. Données : Vm=24L.mol-1
Solution
Exercice1
Répondrons par vrai ou faux en cochant la case correspondante.
|
Affirmations
|
Vrai
|
Faux
|
|
Le jus de citron est acide
|
|
|
|
L’acide chlorhydrique attaque le métal argent
|
|
|
|
Le chlorure d’hydrogène est très soluble dans l’eau
|
|
|
|
Il est possible de garder de l’acide chlorhydrique dans un flacon en aluminium
|
|
|
Exercice2
Equation-bilan :
NaCl+H2SO4→ Na2SO4+2HCl
Na2SO4 : sulfate de sodium
HCl : chlorure d’hydrogène
Exercice3
- Le volume de gaz
2H3O+ +Zn→ Zn2++ 2H2O+H2
nH2=n(H2O)2→nH2=0,5×0,52=0,125mol
VH2=nH2Vm→VH2=0,125×24→VH2=3L
- Calculons de la masse maximale de solide
Zn2++2Cl→ZnCl2
n(ZnCl2)=nZn2+=nH2→mZnCl2=nH2×MZnCl2
An :mZnCl2=0,125×136→m(ZnCl2=17g