LIAISON CHIMIQUE
- Liaison covalente
I.1 Définition
Une liaison covalente résulte de la mis en commun de deux électrons célibataires provenant de deux atomes pour former un doublet liant.
Exempl
I.2 La valence
La valence d’un atome est le nombre de liaison de covalence qu’il peut former. Le nombre de liaisons covalentes qu’un atome peut former est égale au nombre d’électrons qu’il doit acquérir pour saturer sa couche externe à un octet d’électron (ou un duet d’électrons).
Exemple :
|
A tome
|
hydrogène
|
Carbone
|
Azote
|
Oxygène
|
Chlore
|
|
Formule
de
Lewis
|
 |
 |

|
 |
 |
|
Valence
|
1
(monovalent)
|
4
(tétravalent)
|
3
(trivalent)
|
2
(divalent)
|
1
(monovalent)
|
I.3 Molécule
I.3.1 Définition
On appelle molécule tout édifice chimique, électriquement neutre ; formé d’atomes liés entre eux par des liaisons covalentes.
NB : Dans la molécule on peut retrouver différents types de liaisons covalentes :
- La liaison covalente simple : un électron de A se lie avec un électron de B. Entre A et B on a une liaison covalente simple : A–B
- La liaison covalente double : deux électrons de A se lient avec deux électrons de B. Entre A et B, on a une liaison covalente double : A=B
- La liaison covalente triple : trois électrons de A se lient avec trois électrons de B. Entre A et B, on a une liaison covalente triple : A≡B
I.3.2 Formule brute
La formule brute d’une molécule est constituée des symboles des différents éléments affectés en indice de coefficient indiquant leur nombre dans la molécule.
Exemple : Cl2 ; H2 ; CH4
I.3.3 Atomicité d’une molécule
L’atomicité d’une molécule représente le nombre d’atome qu’elle comporte.
Exemple :
- La molécule de HCl ,est constituée de deux atomes (atomicité 2).
- La molécule de NH3, est constituée de quatre atomes (atomicité 4).
I.3.4 Représentation de Lewis d’une molécule
La représentation de Lewis d’une molécule est une représentation des atomes et tous les doublets d’électrons périphériques liants et non liants de cette molécule.
Exemple :

I.3.5 La formule développée et semi développée d’une molécule
La formule développée d’une molécule est une représentation de Lewis de la molécule où les doublets non liants ne sont pas représentés.
- La formule semi développée
La formule semi développée est une écriture simplifiée de la formule développée dans la quelle les liaisons de types X-H O-H;N-H;C-H…etc ne sont pas représentées.
Exemple : CH3-CH2-OH
I.3.6 Structures et géométrique de quelles molécules
|
Nom et formule brute
|
Représentation de Lewis
|
Formule développée
|
géométrie
|
|
Dihydrogène
H2
|

|

|
Linéaire
|
|
Dichlore
Cl2
|

|

|
Linéaire
|
|
Dioxygène
O2
|

|

|
Linéaire
|
|
Chlorure d’hydrogène
HCl
|

|

|
Linéaire
|
|
Eau
H2O
|

|

|
Triangulaire
|
|
Ammoniac
NH3
|

|

|

|
|
Méthane
|

|

|

|
I.4 Liaison covalente polarisée et liaison d’active
I.4.1 L’électronégativité
L’électronégativité est la tendance d’un atome à capter des électrons. Elle traduit d’un atome à attirer les électrons de liaison.
Remarque : L’électronégativité augmente de la gauche vers la droite d’une période et du bas vers le haut d’une colonne dans le tableau de classification périodique.
l’électropositivité est la tendance d’un élément chimique à céder des électrons.
I.4.2 Liaison covalente polaire
Lorsqu’une liaison covalente s’établit entre 2 atomes d’électronégativité différente, le doublet électronique liant se déplace du côté de l’atome le plus électronégativité (la paire d’électron est en moyenne plus proche de l’atome le plus électronégatif). La liaison formée est dite polaire.


Exemple :
I.4.3 Liaison dative
Une liaison dative est une description de liaison covalente entre deux atomes pour lesquels les deux électrons partagés dans la liaison proviennent du même atome.
Exemple :

- Liaison ionique
II.1 Définition
Une liaison ionique est une liaison établie par attraction électrostatique entre deux ions de signes opposés. Sa cohésion est assurée par la force d’attraction électrique qui lie les deux ions.
II.2 Le cristal ionique
II.2.1 Formule ionique et formule statistique d’un solide ionique
La formule ionique représente un ensemble électriquement neutre écrit avec les ions constituants du composé.
Exemple :
Chlorure de sodium : (Na+,Cl-)
Fluorure de calcium : (Ca2+, 2F-)
La formule statistique d’un composé ionique représente un ensemble électriquement neutre et indique la proportion de chacun des ions (cation et anion) qui la composent.
Exemple :
Chlorure de sodium : NaCl
Fluorure de Calcium : CaF2
II.2.2 Exemple de cristal ionique : le chlorure de sodium
Le chlorure de sodium se présente sous forme de réseau constitué de mailles élémentaires. dans le réseau les ions ont la disposition suivante : Un ion Na+ est attiré plusieurs ions Cl- et un ion Cl- est attiré par plusieurs ions Na+. Les ions Cl- se repoussent entre eux et les ions Na+ se repoussent entre eux. L'association des forces d'attractions et de répulsions permet d'arriver au résultat suivant : chaque cation est directement entouré d'anions et chaque anion est directement entouré de cations.

Evaluation
EXERCICE1
1/ Rappeler les représentations de Lewis des atomes H, C, O et C?.
2/ En déduire le diagramme de Lewis des molécules : CH2C?2, C2H5C? et H2O2.
EXERCICE2
Dans la molécule d’ammoniac NHn, l’atome d’azote est lié à chaque atome d’hydrogène par une liaison covalente.
1/ Définir une liaison covalente.
2/ Déterminer le schéma de Lewis de l’azote puis déduire la valeur n.
3/ Donner la formule développée et le schéma de Lewis de l’ammoniac
4/ Dire si l’ammoniac est un composé moléculaire ou ionique? Justifier
Réponse
EXERCICE1
1) les représentations de Lewis des atomes H, C, O et C?.




2) le diagramme de Lewis des molécules : CH2C?2, C2H5C? et H2O2.
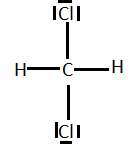
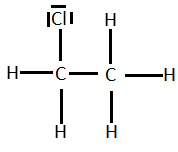

EXERCICE2
1) Une liaison covalente est la mise en commun de deux électrons célibataires de deux atomes pour former un doublet liant.
2) Le schéma de Lewis de l’azote est :
Comme la valence de l’azote est 3 donc on peut avoir que trois liaisons covalentes avec l’atome d’azote d’où n égale à 3.
3) la formule développer et le schéma de Lewis de l’ammoniac :
Schéma de Lewis formule développée


4) l’ammoniac est un composé moléculaire parce qu’on a seulement que des liaisons covalentes simples qui lient les atomes.
Liais