Elément- atome ; tableau de classification périodique des éléments-Liaisons chimiques
- Elément :
- Notion
- Mise en évidence
- expériences :

Ainsi, le sucre renferme le carbone, l’oxygène et l’hydrogène
- Combustion d’une bougie

Ainsi la bougie renferme le carbone
- Electrolyse de l’eau
L’électrolyse de l’eau a permis de démontrer que l’eau renferme l’hydrogène et l’oxygène
- conclusion
Le carbone, l’hydrogène et l’oxygène qui sont des constituants communs à plusieurs corps purs différents sont appelés éléments chimiques
- Définition
Un élément chimique est un constituant commun à plusieurs corps purs simples ou composés
- Représentation symbolique
La représentation symbolique d’un élément chimique est la première lettre du nom latin ou grec écrite en majuscule. Exemple : Hydrogène (H) ; oxygène (O), carbone (C), Fluor (F), Phosphore (P), Potassium (K : dérive de Kalium).
Parfois, pour éviter toute confusion sur le nom, on ajoute à coté de la première lettre en majuscule une seconde lettre écrite en minis cule. Exemple : Hélium (He), Sodium (Na : de Natrinium) , Fer (Fe) , Chrome (Cr) , Neon (Ne) , Calcium (Ca) ,Cadmium (Cd)…
- atome
- Définition
L’atome est la plus partie de la matière qui puisse exister tout en conservant les propriétés d’une matière.
Remarque : nous appellerons molécule le plus petit assemblage d’atomes liés les uns des autres de manière covalente de façon à conserver les propriétés d’un corps purs
- Structure de l’atome
L’atome est un assemblage formé de deux parties :
- Un noyau constitué de protons et de neutrons, autour du quel gravite sur une partie périphérique
- Des électrons formant un nuage électronique. Les électrons tournent autour du noyau avec une vitesse relativement constante
Exemples : atome d’hydrogène

- Les caractéristiques dans l’atome
|
Particule
|
Proton
|
Electrons
|
Neutron
|
|
Charge : en Coulomb : (C)
|
+1,6.10-19C
|
-1,6.10-19C
|
0C
|
|
Masse Kg
|
1 ,67.10-27Kg
|
9,1.10-31 Kg
|
1 ,67.10-27Kg
|
- Les dimensions dans l’atome
Le diamètre de l’atome est de l’ordre de l’Angstrœm : 1A = 10-10m. Exemple : Rayon de l’atome d’Hydrogène RH = 0,53A
- Représentation symbolique du noyau atomique
L’atome est symboliquement représenté par :
ΖΑΧ
A = nombre total de nucléons (protons et neutrons) contenus dans le noyau
X = symbole de l’élément correspondant à l’atome
Z = nombre total de proton contenu dans le noyau ( on l’appelle parfois numéro atomique)
Exemples :
He : 4nucléons dont 2 proton p et deux neutrons n ; U : 235 nucléons dont 92 p et (235-92)= 143n ; 614C ;1940K…
Remarque :
Lorsque la matière est électriquement neutre , alors le nombre de protons est égal au nombre de neutrons
Toute charge électrique est un multiple entier de la charge élémentaire de l’électron e :
q = Ne, N∈?
- Isotopes
- Définition
Deux atomes sont isotopes l’un de l’autre si leurs noyaux renferment le même nombre de protons mais différent par leurs nombre s de neutron ou nombre total de masse
- Exemples
, , et sont isotopes l’un de l’autre
C, , et sont les isotopes du carbone
- Structure électronique et formule électronique
Les électrons tournent autour du noyau atomique sur des trajectoires privilégiées appelée orbite ou rang ou niveau d’énergie. La première orbite est l’orbite de rang n=1, on l’appelle aussi couche K. L e second est l’orbite de rang n=2 ou couche L. L’orbite de rang3 est la couche M. Ensuite vient N….
- Régle de remplissage des niveau d’énergie
- Régle n°1 :
Avant de remplir une couche donnée , il faut veiller d’abord à remplir au maximum les couches précédentes
- Régle n°2
Le nombre d’électrons situés jusqu’à une couche de rang n ( sauf pour K où c’est 2)ne peut dépasser 2n2+2 valeurs
Exemple :
n=1 ⇒ 2 électrons sur la couche K
n=2 ⇒ 2(22) +2 = 10 électrons dont 2 sur la couche K et 8 sur la couche L
n= 3 ⇒ 2(23) +2= 18 électrons dont 2 sur la couche K ,8 sur la couche L et 8 sur la couche M
- Exercice d’application
Déterminer la formule électronique puis la structure électronique de chacun des atomes dont les éléments sont les suivant : H (Z=1) ; B (Z=5) ;C(Z=6) ; Cl(Z=17) ; Na(Z=11) ;K(Z=19)
Réponses :
H (Z=1) :K1
K
B (Z=5) :K2L3
K L
C(Z=6) :K2L4
K L
Cl (Z=17) : K2L8M7
|
..
|
|
..
|
..
|
..
|
..
|
|
..
|
..
|
..
|
.
|
K L M
Na(Z=11) :K2L8M1
K L M
K (Z=19) :K2L8M8N1
|
..
|
|
..
|
..
|
..
|
..
|
|
..
|
..
|
..
|
..
|
|
.
|
|
|
|
K L M N
- tableau de classification périodique des éléments
- Présentation sommaire :

On notera dans une case :
ΖΑΧ


Métaux alcalins(I) Alcalino-terreux (II) Halogènes(VII) Gaz rares(IIX)

|
11H
Hydrogène
|

|
24He
Hélium
|
|
36Li
Lithium
|
49Be
Béryllium
|
510B
Bore
|
612C
Carbone
|
714N
Azote
|
816O
Oxygène
|
919F
Fluor
|
1020Ne
Néon
|
|
1123Na
Sodium
|
1224Mg
Magnésium
|
1327Al
Aluminium
|
1428Si
Silicium
|
1531P
Phosphore
|
1632S
Soufre
|
1735Cl
Chlore
|
1839Ar
Argon
|
|
1940K
Potassium
|
2040Ca
Calcium
|
|
- Description et interprétation ;
Le tableau est formé de ligne et de colonne. Les éléments appartenant à la même ligne sont de la même période ou rang. Les éléments appartenant à la même colonne sont de la même famille ou groupe. Ainsi, les éléments de la 1ère colonne constituent la famille des métaux alcalins, ils sont secs, excellents conducteurs de courant et d’électricité. Les métaux alcalino-terreux occupent la deuxième colonne, ils sont moux malléables, isolants donc faiblement conducteur de courant et d’électricité. Les halogènes constituent la 7ième famille, ce sont le Cl, Br, I, et F. La dernière colonne est occupée par les gaz rares que l’on appelle aussi gaz nobles à cause de leur très grande stabilité
- Liaisons chimiques
- Schéma de Lewis
Le Schéma de Lewis consiste à écrire le symbole de l’élément autour duquel on répartie les électrons situés sur la dernière couche de l’atome.
Remarque ; un point (.) représente un électron libre (célibataire) ; un tiret (-) représente un doublet apparié de 2 électrons.
Exemples :
donnons les Schémas de Lewis des éléments de l’exercice précédant ;
H (Z=1) :K1⇒  ; B (Z=5) :K2L3 ⇒
; B (Z=5) :K2L3 ⇒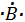 ; C (Z=6) :K2L4⇒
; C (Z=6) :K2L4⇒ ; Cl (Z=17) : K2L8M7 :
; Cl (Z=17) : K2L8M7 :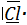 ;
;
Na (Z=11) :K2L8M1 :  ; K (Z=19) :K2L8M8N1 :
; K (Z=19) :K2L8M8N1 : 
- Régle de l’Octet
Les atomes ont tendance à gagner ou perdre des électrons de manière à acquérir la structure électronique du gaz rare le plus proche. Donc, 8 électron sur la dernière couche , sauf pour la couche K où la stabilité maximum est 2 électron sur cette couche.
- Notion d’ion
Un cation est un atome qui a perdu un ou plusieurs électrons. Un anion est un atome qui a gagné un ou plusieurs électrons.
Exemples :
Na (Z=11) :K2L8M1 a tendance à perdre un électron pour satisfaire la règle de l’Octet en se transformant en ion positif ou cation Na+ dont la formule électronique de l’ion est2L8
Cl (Z=17) : K2L8M7 a tendance à gagner un électron pour être stable en se transformant en ion négatif ou anion Cl- .
- Liaison covalente
- Cas de HCl
H + Cl H-Cl
K1 K2L8M7
Comme le Chlore ; l’Hydrogène a besoin de gagner un électron pour être stable. Alors, les deux atomes vont se lier en mettant chacun en commun d’1 électron.
- Définition
Une liaison covalente est une mise en commun d’un ou de plusieurs électrons entre atomes voisins.
Exemples

Remarque :
La valence d’un élément est le nombre de liaisons que peut former cet élément avec d’autre ; c’est aussi le nombre d’électron libre situé sur la dernière couche de cet élément
Exemple :
Eléments monovalents : H ,les halogènes ; divalents : O,S ; trivalents : N,P, tétravalent :C
Exercice :
- Proposer des schémas de Lewis et formules développées des différentes molécules suivantes : CH4 ; C2H6 ; C3H8 ; C4H10 ; C2H7N ; C2H6
- En déduire les formules semi-développées correspondantes
Réponse :

- Liaison ionique
- Cas de NaCl Chlorure de sodium
Na + Cl (Na+ ; Cl -) (formule ionique)
K2L8M1 K2L8M7 NaCl (formule statique)
Interprétation :
Pour être stable, Na a besoin de perdre un électron, alors Cl a besoin d’en gagner un. Ainsi, les deux atomes vont se lier après transfert d’1 électron du Sodium au Chlore. La liaison sera maintenue par interaction électrostatique
- Définition
Une liaison ionique est une liaison au cours de laquelle il y’a un transfert d’un ou de plusieurs électrons d’une entité à une autre.
- Autres exemples
Chlorure de calcium
Ca + 2Cl (Ca2+ ; 2Cl -) (formule ionique)
K2L8M8N2 K2L8M7 CaCl2 (formule statique)
Sulfure d’Aluminium
2Al + 3S (2Al3+ ; 3S2 -) (formule ionique)
K2L8M3 K2L8M6 Al2S3 (formule statique)
- Les composés à liaisons mixte :
- formule statique et nom :
Le nom du composé statique s’obtient en citant le nom de l’anion suivi du cation. Par contre dans l’écriture, on écrit d’abord le symbole du cation suivi de l’anion. Leurs nombres sont indiqués en indice devant le symbole de l’élément ou groupe d’atomes considérés.
Remarque : noms de quelques ions
Anions :
Cl- ion chlorure; Br - ion bromure; F- ion fluorure; I- ion iodure; S2– ion sulfure;
Cations :
Ag+ ion argent (I) ; Al3+ ion aluminium (III); Ca2+ ion calcium; Fe2+ ion fer (II) ou ferreux; Fe3+ ion ferrique ou fer(III);Cu+ ion cuivreux ou cuivre (I) ; Cu2+ ion cuivre (II) ou cuivrique
Cas d’ions mixtes :
SO42– ion sulfate ; NO3– ion nitrate ; MnO4– ion permanganate; Cr2O72– ion chromate ; HO– ion hydroxide; H3O+ ion hydronium; NH4+ ion ammonium
- Exercice d’application
Remplir le tableau suivant :
|
Couples ioniques
|
Formules statiques
|
Noms
|
|
(Ag+ ; F–)
|
AgF
|
Fluorure dd’argent
|
|
Ca2+ ;2 I–)
|
CaI2
|
Iodure de calcium
|
|
(Cu2+ ; S2–)
|
CuS2
|
Sulfure cuivrique ou sulfure de cuivre (II)
|
|
(Fe2+ ; SO42–)
|
Fe(SO4)
|
Sulfate de fer (II) ou sulfate ferreux
|
|
((Cr3+ ; 2Cl–)
|
CrCl2
|
Chlorure de chrome(III)
|
|
(Cu3+ ; 3Cl–)
|
CuCl3
|
Chlorure cuivrique
|
|
(2Fe3+ ; 3Cr2O72–)
|
Fe2(Cr2O7)3
|
Dichromate de fer (III)
|
|
(Ag+ ; NO3–)
|
AgNO3
|
Nitrate d’argent
|
|
(Ca2+ ; 2HO–)
|
Ca(OH)2
|
Hydroxyde de calcium
|
|
(2H3O+ ;S2–)
|
S(H3O)2
|
Sulfure d’hydronium
|
|
(Fe3+ ;3MnO4–)
|
Fe(MnO4)3
|
Permanganate ferrique
|
|
(NH4+ ; ClO3–)
|
(NH4)ClO3
|
Chlorate d’ammonium
|